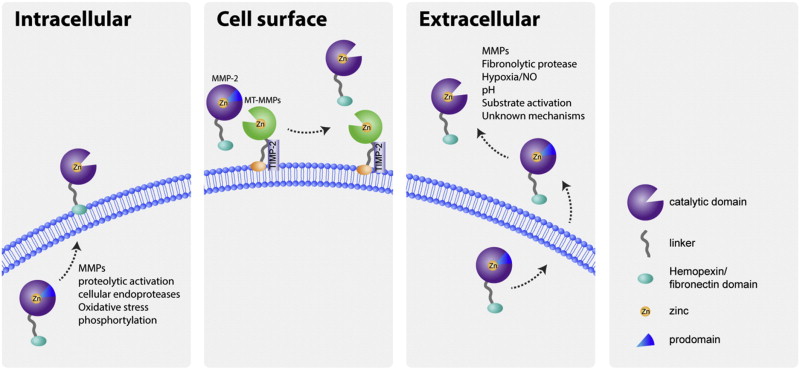
متالوپروتئینازهای ماتریکس (MMPs) آنزیم های پروتئولیتیک وابسته به روی هستند که پروتئین های مختلف را در ماتریکس خارج سلولی (ECM) تجزیه می کنند. MMP ها همچنین ممکن است فعالیت گیرنده های غشایی و مکانیسم های سیگنال دهی پس گیرنده را تنظیم کنند و در نتیجه بر عملکرد سلول تأثیر بگذارند.

MMP ها یک ساختار مشترک دارند. سه حوزه رایج عبارتند از پروپپتید، دامنه کاتالیزوری، و دامنه C ترمینال شبه هموپکسین، که توسط یک ناحیه لولای انعطاف پذیر به حوزه کاتالیزوری مرتبط است.
پروپپتید
MMP ها در ابتدا به عنوان زیموژن های غیرفعال با یک دامنه پروپپتیدی سنتز می شوند که باید قبل از فعال شدن آنزیم حذف شوند. دامنه پروپپتید بخشی از “سوئیچ سیستئین” است. این حاوی یک باقیمانده سیستئین است که با روی در محل فعال تعامل می کند و از اتصال و جدا شدن سوبسترا جلوگیری می کند و آنزیم را به شکل غیر فعال نگه می دارد. در اکثر MMP ها، باقی مانده سیستئین در توالی حفظ شده PRCGxPD است. برخی از MMPها دارای یک محل برش پروهورمون کانورتاز (مانند فورین) به عنوان بخشی از این دامنه هستند که وقتی شکافته می شوند، آنزیم را فعال می کنند. MMP-23A و MMP-23B شامل یک بخش گذرنده در این حوزه هستند.
حوزه کاتالیزوری
ساختارهای کریستالوگرافی اشعه ایکس چندین حوزه کاتالیزوری MMP نشان داده است که این حوزه یک کره مایل به اندازه 30×30×35 Å (3.5×3×3 نانومتر) است. سایت فعال یک شیار 20 Å (2 نانومتر) است که در سراسر دامنه کاتالیزوری اجرا می شود. در بخشی از حوزه کاتالیزوری که سایت فعال را تشکیل می دهد، یک یون Zn2+ از نظر کاتالیزوری مهم وجود دارد که توسط سه باقی مانده هیستیدین موجود در توالی حفظ شده HExxHxxGxxH محدود شده است. از این رو، این دنباله یک موتیف اتصال روی است.
ژلاتینازها، مانند MMP-2، ماژولهای فیبرونکتین نوع II را که بلافاصله قبل از آن در موتیف اتصال روی در حوزه کاتالیزوری وارد شدهاند، ترکیب میکنند.
منطقه لولا
دامنه کاتالیزوری توسط یک لولا یا ناحیه پیوند دهنده انعطاف پذیر به دامنه C ترمینال متصل می شود. این تا 75 اسید آمینه طول دارد و ساختار قابل تعیینی ندارد.




 1346 کاربر
1346 کاربر  5 محصول
5 محصول  1856 مطلب
1856 مطلب  238 دیدگاه
238 دیدگاه  t.me/link10_ir
t.me/link10_ir