
تَصَلُّبِ شَرایین نام یک بیماری در رگها و نوعی آرتریواسکلروزیس است که با رسوب لیپید و کلسترول کمچگال بر روی دیواره داخلی سرخرگهای با قطر متوسط و بزرگ، مشخص میگردد. نتیجه این فرایند تشکیل پلاکهای فیبری-چربی (آتروما) بوده که با افزایش سن رفته رفته ازدیاد مییابد و موجب تنگی رگ (استنوزیس) یا دیگر عواقب میگردد.
تصلب شرایین یکی از دلایل عمده مرگ و میر در بزرگسالان در جوامع پیشرفته و نیز کشورهای با میزان بالای استرس است، بهطوریکه برای ایران، بتنهایی سالانه حدود سیصد هزار مرگ قلبی مرتبط دربردارد
فیزیوپاتولوژی
آتروما (Atheroma) ضخیم شدن غیر قرینه انتیما (Intima)، درونیترین لایه رگهای متوسط و بزرگ است. مجرای درون رگ با ضخیم شدن لایه انتیما تنگ میشود. ضایعه از تشکیل نوارهای درخشنده چربی (Fatty Streaks) در لایه انتیما در افراد جوان که حاوی سلولهای حباب دار است شروع و در سیر خود به پلاک فیبروآتروماتو (Fibroatheromatous)، پلاک فیبروزه (Fibrous) و پلاکهای عارضه دار (Complicated plaque) تبدیل میشود.
با توجه به آن که هیپرکلسترولمی، دیابت، کشیدن سیگار، چاقی، پرفشاری خون و زندگی بی تحرک و نشسته از عوامل خطرساز در بروز این ضایعات شناخته شدهاند تا ۱۰ سال قبل تصور میشد که با کنترل این عوامل به ویژه هیپرکلسترولمی و پرفشاری خون، بتوان تا آخر قرن بیستم ابتلا به بیماریهای کرونری را محدود ساخت. اما به نظر میرسد وجود عوامل دیگری موجب شکست در این امر شدهاست.
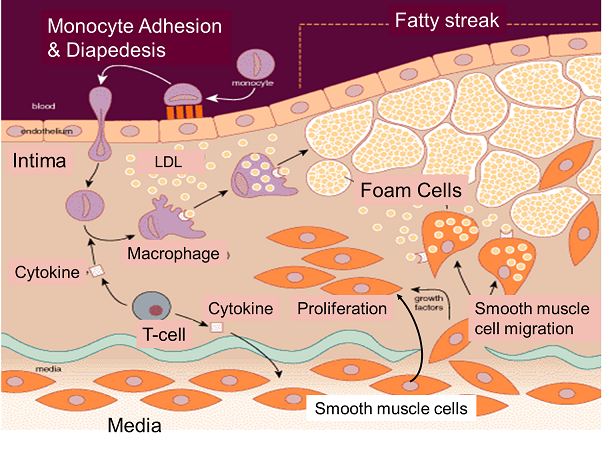
این ضایعه از سلولها، عناصر موجود در بافت همبند، چربی و مواد حاصل از تخریب سلولی تشکیل شدهاست. سلولهای التهابی و ایمنی که از خون وارد این ضایعه میشوند یکی از بخشهای اصلی این ضایعه را تشکیل میدهند. باقی سلولهایی که در ساختار این ضایعه دیده میشوند عبارتاند از سلولهای اندوتلیوم و عضلات صاف. سلولهایی با ظاهر حباب دار و کف آلود (Foam cells) همراه با قطرات چربی آزاد خارج سلولی در مرکز ضایعه آترومی دیده میشوند که توسط یک سرپوش متشکل از سلولهای عضلانی و یک ماده زمینهای پر از کلاژن محدود شدهاند. سلولهای لنفوسیتT، ماکروفاژها و ماست سلها به این ضایعه نفوذ نموده و به ویژه در کنارههای ضایعه که برجستگی آن به شکل یک لبه به بخش سالم درونی رگ میپیوندد (و حالت شانه مانندی در اطراف ضایعه به وجود میآورد) به تعداد زیاد دیده میشوند. از این محل شانه مانند است که ضایعه آترومی گسترش مییابد. علائم حاکی از فعالیت التهابی در بسیاری از سلولهای ایمنی موجود در آتروم دیده شده و سیتوکینهای بسیاری توسط این سلولها تولید میگردد.
به نظر میرسد هیپرکلسترولمی موجب فعال شدن موضعی سلولهای اندوتلیوم در شریانهای بزرگ و متوسط گشته و احتباس لیپویروتئینها، به ویژه با جرم حجمی کم (LDL)، در لایه انتیما عامل اصلی در شروع روند تشکیل آتروم باشد. اکسیداسیون این لیپوپروتئینها توسط رادیکالهای آزاد که توسط ماکروفاژها تولید میگردد و تغییر آنزیمی آنها در انتیما موجب تولید لیپیدهایی میشود که از نظر حیاتی فعال میباشند.
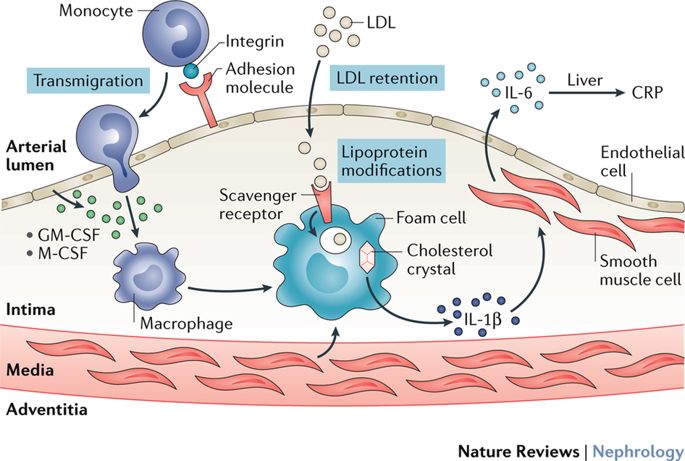
سلولهای اندوتلیوم و عضلانی صاف موجود در محیط آتروم ممکن است دارای نقش مهمی نیز در این روند باشند. این لیپوپروتئینهای اکسید شده باعث آزاد شدن فسفولیپیدهایی میشوند که سلولهای اندوتلیوم را به ویژه در محلهایی از رگ که تحت فشار همودینامیک است فعال میسازند. LDLهای اکسیده شده خود محرک واکنشهای التهابی بوده موجب جذب مونوسیتهای خون و بسیج و تکثیر ماکروفاژهای حاصل از مونوسیتهای جذب شده میگردد. این واکنشهای التهابی برای از بین بردن LDLهای اکسیده شده پدید میآید. در این سیر، چربیهای اکسیده شده ماکروفاژها را بیشتر فعال کرده و پدیده اکسیداسیون خود را تشدید میکنند. در حضور هیپرکلسترولمی، پاسخهای التهابی که برای خنثی کردن اثر LDLهای اکسیده شده آغاز میشوند نمیتوانند عملکرد خود را کامل کنند و در عوض چرخه التهاب، اکسیده شدن لیپوپروتئینها و و بروز التهاب بیشتر در انتیما باقی میماند. لنفوسیتهای T که از مراحل اولیه در ضایعه آترواسکلروتیک حضور دارند واکنشهای التهابی را به صورت یک چرخه معیوب تشدید میکنند. سلولهای ماکروفاژ و عضلات صاف با ولع لیپوپروتئینهای اکسیده را میبلعند و سیتوپلاسم آنها از قطرات حاوی استرهای کلستریل پر شده و به آنها ظاهر حباب دار و کف آلود (Foam cells) میدهد.
همچنین جریان خون در محلهایی از رگ که مستعد ابتلا به آترواسکلروز است (محل دو شاخه شدن شریان) به گونهای است که سلولهای اندوتلیوم را تحت فشار قرار میدهد. این امر موجب افزایش مولکولهایی (Adhesion molecules) در سطح سلول اندوتلیوم میشود که قدرت چسبیدن این سلولها را به محیط و سلولهای دیگر افزایش میدهند. هم چنین مولکولهای التهابی در این محیط پر فشار توسط سلولهای اندوتلیوم بیشتر تولید میگردد. به این شکل فشارهای همودینامیک و افزایش لیپوپروتئینهای خون موجب فعال شدن روند التهاب در دیواره شریان میشوند
نقش پلاکتها در تصلب شرایین
پلاکتها از عناصر کلیدی در تشکیل و گسترش پلاکهای آترومی بهشمار میروند. این سلولها در روند انعقاد خون هنگام بروز آسیب به رگها موجب توقف خونریزی میشوند. پلاکتها اولین سلولهای خونی هستند که در محل فعال شدن سلولهای اندوتلیوم حاضر میشوند. گلیکوپروتئینهای Ib و IIb/IIIa موجود در سطح این سلولهای بدون هسته با مولکولهای موجود در سطح سلولهای اندوتلیوم در هم گیر کرده این امر خود میتواند در فعال شدن بیشتر سلولهای اندوتلیوم دخیل باشد. مهار کردن این مولکولها در پلاکتها از نفوذ لکوسیتها و هم چنین پدید آمدن آترواسکلروز در موشهایی که مبتلا به هیپرکلسترولمی هستند جلوگیری مینماید.
اهمیت تشکیل لخته (thrombosis) در بروز سندرومهای کرونری حاد (شامل آنژین ناپایدار، آنفارکتوس میوکارد بدون موج Q، آنفارکتوس حاد با بالا رفتن قطعه ST و بسته شدن ناگهانی مجرای رگ کرونر پس از بازکردن درمانی آن) ثابت شدهاست. اعتقاد بر این است که فعال شدن پلاک آترومی و تشکیل یک لخته که مجرا را مسدود میسازد موجب بسته شدن حاد رگ و بروز آنفارکتوس میشود. سرپوش موجود بر روی پلاک با افزایش فعالیت سلولهای التهابی و تولید آنزیمهای پروتئولیتیک تضعیف شده و هم چنین سلولهای مرکزی در ضایعه فعال میشوند. این امر در نهایت موجب شکاف خوردن پلاک در این محل میگردد. هم چنین سلولهای اندوتلیوم ممکن است به علت فشار جریان خون عبوری از کنار پلاک آترومی از روی آن کنده شوند. هم شکاف خوردن پلاک آترومی و هم کنده شدن سلولهای اندوتلیوم از روی آن میتواند لایه زیر اندوتلیوم را در محل ضایعه در برابر عناصر موجود در خون قرار دهد.
هنگامی که پلاکتها به دنبال این دو پدیده در برابر لایه زیر اندوتلیوم قرار میگیرند با واسطه گلیکوپروتئینهای گروه Ib/IX/V به محل ضایعه میچسبند. فاکتور فون ویلبراند (von Willebrand) به میزان زیادی موجب تشدید این روند میشود. پلاکتها به دنبال چسبیدن به لایه زیر اندوتلیوم و آزاد شدن ترکیبات متعددی از جمله آدنوزین دی نوکلئوتید فسفات (ADP)، سروتونین (Serotonin)، ترومبوکسان (Thromboxan)، ترومبوسپاندین (Thrombospondin) و فیبرینوژن (Firbrinogen) به محیط اطراف ضایعه فعال میشوند. ترومبین (Thrombin) و کلاژن از فعالکنندههای قوی پلاکت و ترومبوگزان، سروتونین (Serotonin)، وازوپرسین (Vasopressin), ADP، فاکتور فعالکننده پلاکتی (Platelet-activating factor) و اپینفرین (Epinephrine) از فعالکنندههای ضعیف این سلولها بهشمار میروند. بر روی سطح پلاکتها گیرندههایی وجود دارد که با چسبیدن ترکیبات فوق به آنها پدیده چسبیدن پلاکتها به دیواره رگ و اتصال آنها به یکدیگر گسترش مییابد. از آن جمله میتوان به گیرندهای به نام گلیکوپروتئین IIb/IIIa (GP IIB/IIa) اشاره کرد.
گیرنده GP IIb/IIIa به خانواده اینتگرینها (Integrin) تعلق دارد که از گلیکوپروتئینهای موجود در روی غشاء سلولها بهشمار آمده و به توسط آنها سلولها به ترکیبات مختلف یا به سایر سلولها میچسبند. هر پلاکت در گردش خون دارای ۵۰۰۰۰ تا ۸۰۰۰۰ گیرنده GP IIb/IIIa است که بیشتر آنها در سطح سلول پراکنده شده و تعداد کمی به عنوان ذخیره در داخل پلاکت جای گرفتهاند. اهمیت وجود و عملکرد صحیح این گیرنده برای اولین بار در بیماران مبتلا به ضعف پلاکتی گلانزمن (Glanzmann’s thromboasthenia) مورد توجه قرار گرفت. با آن که فیبرینوژن مولکول اصلی پیوندی با این گیرنده میباشد اما فیبرونکتین (Fibronectin)، ویترونکتین (Vitronectin) و فاکتور وون ویلبراند (von Willebrand) از ترکیبات دیگری هستند که از این گیرنده به عنوان محل اتصال به پلاکت استفاده میکنند. این گیرنده در حالت استراحت هیچ تمایلی به اتصال به فیبرینوژن ندارد. ترکیباتی که قادرند پلاکتها را فعال نمایند از راه یک پیام از «درون به بیرون» (Inside-to-outside signal) تغییری در ساختار گیرنده GP IIb/IIIa پدید میآورند که به دنبال آن امکان چسبیدن فیبرینوژن به این گیرنده فراهم میآید و در واقع به واسطه آنها این گیرنده فعال میشود. به این شکل مولکول فیبرینوژن به صورت پلی میان پلاکتها عمل نموده و موجب تشکیل شبکه در هم بافتهای از پلاکتها یا به عبارت دیگر تجمع یافتن پلاکتها میگردد. برعکس، با اتصال فیبرینوژن و فاکتور فون ویلبراند به این گیرنده یک پیام از «بیرون به داخل» (Outside-to-inside signal) پدید میآید که موجب تغییر در میزان سیال بودن غشای پلاکت، تغییر شکل توبولها و اسکلت سلولی، جریان یافتن و بهکارگیری کلسیم داخل سلولی و تولید گیرندههای جدید بر روی سطح پلاکت میگردد. باید اشاره کرد که ترومبین میزان تظاهر گیرنده GP IIb/IIIa را در سطح پلاکت تا ۵۰٪ افزایش میدهد. بر عکس کمی سطح فیبرینوژن در پلاسما، میتواند اثر ضد لختهای مهارکنندههای این گیرنده را تشدید نماید چرا که نبود فیبرینوژن کافی از فعال شدن این گیرنده به میزان کافی جلوگیری میکند. این روند رابطه میان گیرنده GP IIB/IIIa با سایر عملکردهای مهم پلاکتها از جمله تخلیه محتویات گرانولهای درون پلاکت (که خود حاوی ترکیبات فعالکننده پلاکتی هستند) را بر قرار میسازد. بدون در نظر گرفتن محرک اولیهای که موجب فعال شدن پلاکتها میگردد مسیر انتهایی مشترک در تشکیل و گسترش لخته در محل ضایعه آترواسکلروتیک به واسطه همین گیرنده GP IIB/IIIa صورت میپذیرد.





 1360 کاربر
1360 کاربر  5 محصول
5 محصول  1856 مطلب
1856 مطلب  238 دیدگاه
238 دیدگاه  t.me/link10_ir
t.me/link10_ir